中央流行疫情指揮中心今(16)日公布國內新增170例COVID-19確定病例,分別為167例本土個案及3例境外移入;確診個案中新增18例死亡。
新北65台北50苗栗21最多
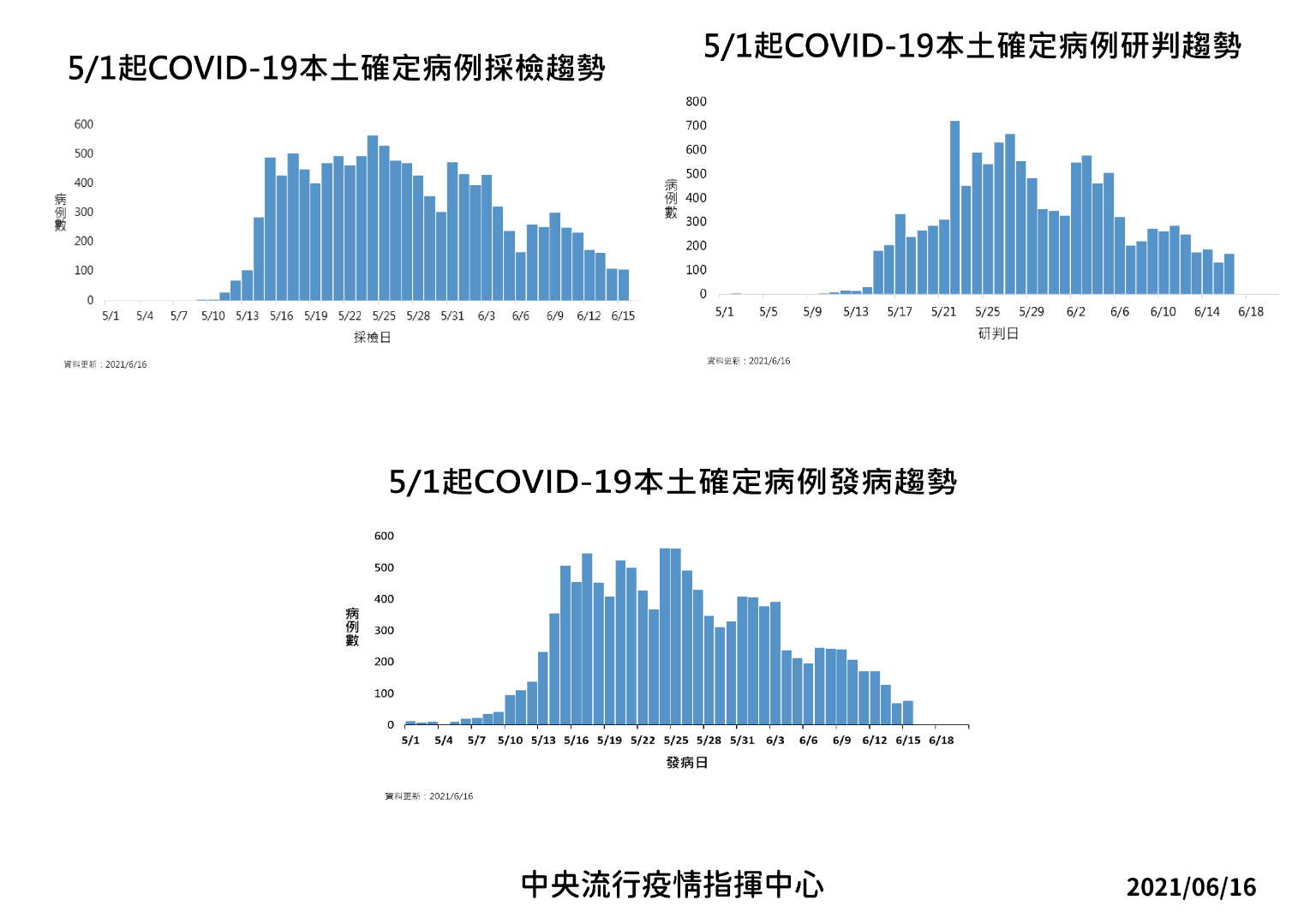
指揮中心指揮官陳時中表示,今日新增之167例本土病例,為85例男性、82例女性,年齡介於未滿5歲至90多歲,發病日介於今年6月1日至6月15日。個案分佈以新北市65例最多,其次為臺北市50例,苗栗縣21例,桃園市14例,花蓮縣8例,新竹縣5例,基隆市2例,高雄市及臺中市各1例。其中雙北地區以外縣市52例中,48例為已知感染源、4例關聯不明;相關疫情調查持續進行中。

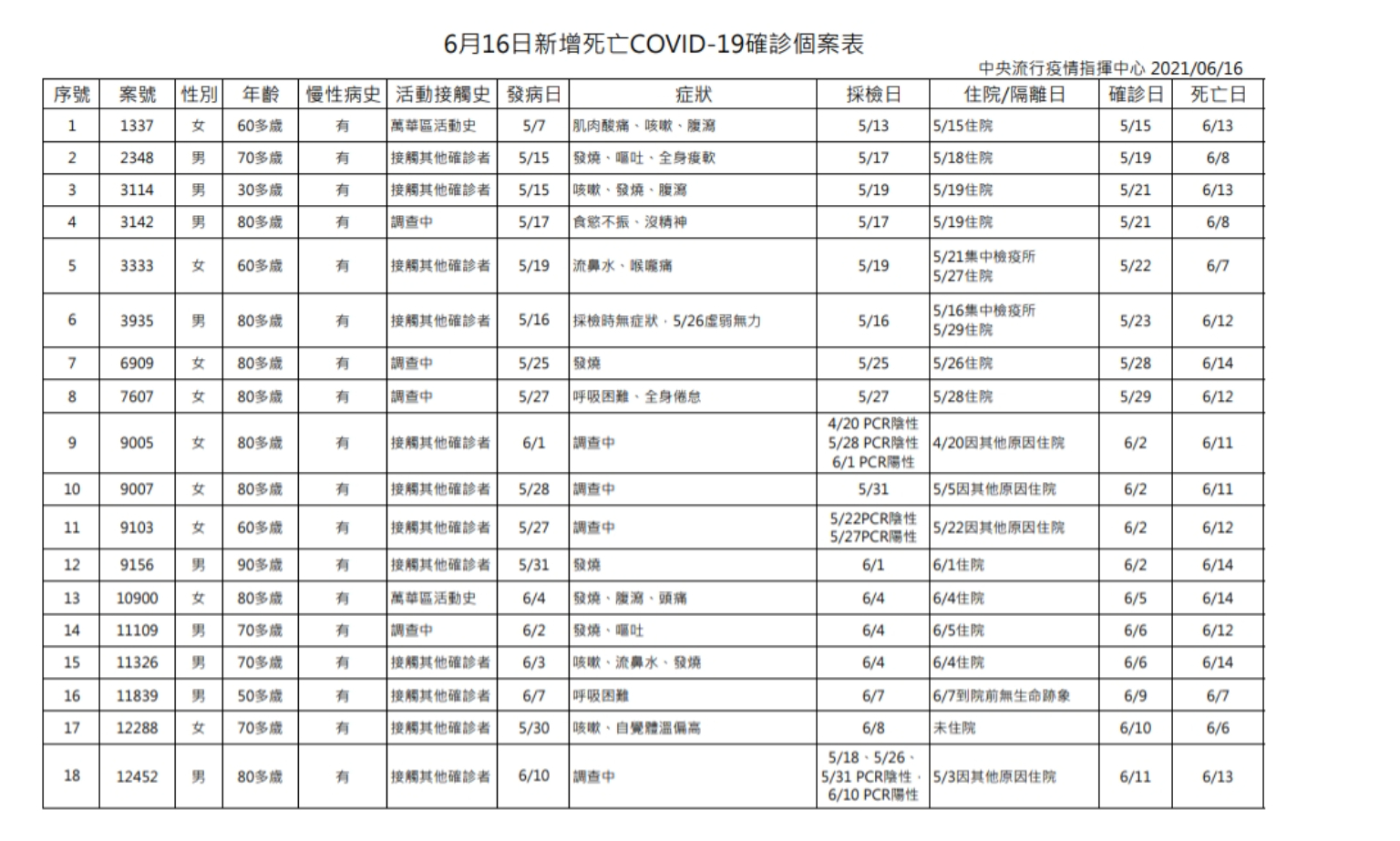
新增18例死亡個案,確診個案中478人死亡
陳時中說明,今日新增18例死亡個案,共計為男性9位、女性9位,年齡介於30多歲至90多歲,發病日介於5月7日至6月10日,確診日介於5月15日至6月11日,死亡日介於6月6日至6月14日,詳如新聞稿附件。
陳時中指出,近期確診個案解隔離情形,5月11日至6月14日累計公布11,907位確診個案中,已有6,373人解除隔離,解隔離人數達確診人數53.5%。
新增3例境外移入,均自菲律賓入境
陳時中表示,今日新增3例境外移入個案中,案13371、案13372均為菲律賓籍20多歲男性船員,分別於5月13日及5月5日自菲律賓來臺工作,皆持有搭機前3日內檢驗陰性報告,且居家檢疫期滿採檢結果均為陰性。2人為同船船員,在臺期間並無症狀,6月14日因出境需求,一同自費採檢,於今日確診;衛生單位已匡列2人接觸者共19人,均列自我健康監測。案13501為本國籍20多歲男性,5月24日自菲律賓返臺,持有搭機前3日內檢驗陰性報告,檢疫期滿後於6月9日出現發燒、咳嗽症狀,就醫後返家持續自主健康管理,6月15日因症狀持續就醫採檢,於今日確診;衛生單位已匡列相關接觸者2人,列居家隔離。
指揮中心統計,截至目前國內累計937,150例新型冠狀病毒肺炎相關通報(含914,861例排除),其中13,409例確診,分別為1,161例境外移入,12,195例本土病例,36例敦睦艦隊、2例航空器感染、1例不明及14例調查中,另新增2例空號(案12511、12767),累計94例移除為空號;確診個案中478例死亡。
指揮中心再次呼籲,民眾應落實手部衛生、咳嗽禮節及佩戴口罩等個人防護措施,減少不必要移動、活動或集會,避免出入人多擁擠的場所,或高感染傳播風險場域,並主動積極配合各項防疫措施,共同嚴守社區防線。
-01.jpg)
18日配發第二批莫德納疫苗,供第一至第三類人員接種含機組員
中央流行疫情指揮中心今日表示,將於6月18日起,配送第二批莫德納(Moderna)COVID-19疫苗73,200劑,同時開放第一類至第三類對象接種,請獲配之合約醫療院所開啟預約掛號服務,提供上述對象預約接種,提升群體免疫力。
陳時中說明,莫德納(Moderna)COVID-19疫苗已於6月9日起陸續提供第一類醫事及非醫事人員接種,截至昨(15)日累計接種3萬7,505人。為儘速提升第二類及第三類對象免疫保護力,將於6月18日起進行第二次配送,同時開放至第三類對象接種。本次疫苗配送量是以各縣市符合第一類至第三類對象中,尚未接種人數接種率4成核估,同時考量疫情風險程度,高風險縣市(臺北市、新北市)分配數量係以尚未接種人數接種率達5成以上計算,總計配送63,200劑。
陳時中表示,另10,000劑疫苗提供交通部認定之第二類及第三類對象所需疫苗量,其中分配給國籍航空機組員5,000劑,含長榮、立榮、華航、華信、台灣虎航、星宇及飛特立等7家公司的駕駛員、空服員與隨機維修員等;另外5,000劑分配給民航航空第一線人員,含桃園機場及相關廠商、民航局、航空站、航管人員、飛機維修、倉儲、地勤及空廚等人員。
指揮中心提醒,為確保疫苗接種安全,建議先前曾因接種疫苗或任何注射治療後發生急性過敏反應之民眾,接種後請於接種處或附近留觀至少30分鐘,一般民眾則建議至少留觀15分鐘,並自我密切觀察15分鐘,以利即時處置該類急性過敏反應。另,依據各國疫苗上市後安全性監測,曾有報告極少數年輕族群在接種mRNA 疫苗後發生心肌炎等的不良反應事件,大多發生在接種後數天內,指揮中心特別提醒民眾,接種mRNA 疫苗後,應注意如出現胸痛、喘或心悸等症狀,請立即就醫並說明疫苗接種史。
指揮中心強調國產疫苗審查皆以科學、專業為原則
中央流行疫情指揮中心今日指出,近日有媒體報導「國光在疫苗研發上,疑因試驗基準不公而慘遭淘汰」及「聯亞遭受衛福部刁難,所提的第三期臨床試驗替代方案遭漠視」等相關訊息,指揮中心嚴正澄清,衛生福利部食品藥物管理署(下稱「食藥署」)及財團法人醫藥品查驗中心(下稱「醫藥品查驗中心」)對於國內COVID-19疫苗臨床試驗計畫申請,皆採取一致性審查標準,包括諮詢輔導、召開週會及專家會議均一視同仁,秉持公平公正,提供最合適、最可行之法規科學建議,並無偏袒特定廠商。
指揮中心表示,有關國光公司申請第二期臨床試驗一事,食藥署已於110年2月9日函復廠商審查結果,也於函中敘明食藥署之考量,絕無審查不公相關情事。另,有關報導所提聯亞公司提出「圈選接種 (Ring Vaccination)」的國內第三期臨床試驗規劃,食藥署及醫藥品查驗中心亦於諮詢週會給予相關建議,例如:如何選擇指標個案、樣本數估算、施打及追蹤時程、施打劑數之合理性等,供廠商進行相關評估,但截至目前食藥署仍未收到該廠商後續規劃及申請。
指揮中心指出,考量疫情及國際公共衛生緊急需求,為加速國產疫苗及早上市,針對COVID-19疫苗研發及輔導,食藥署及醫藥品查驗中心採滾動式審查機制(rolling review),並針對重要關鍵製程,派員駐廠監製,協助廠商於研發過程能符合法規要求,以縮短研發及審查時程,並確保疫苗品質、安全及療效。
指揮中心表示,該中心採購COVID-19疫苗,包括先前採購國外疫苗,均為預採購模式。此次採購國產疫苗是依據政府採購法第105條第1項第2款「因人民之生命、身體、健康、財產遭遇緊急危難」辦理。惟採購合約細節基於保密要求,相關資訊暫不便對外透露。