健保署曾對外公布癌症新藥審查平均時間為411天(約13.7個月),但這個數字卻與長年整理新藥納保時間的和信醫院藥學部主任陳昭姿的統計平均783天(約26.1個月)相差甚遠。
根據癌症希望基金會統計了自2016年迄今在健保署「新藥及新醫材病友意見分享平台」蒐集病人意見的癌症藥品或適應症,4成超過480天(約16個月)生效(正式納入健保給付),目前待共擬會審查的癌症藥品,至少7個品項等待超過12個月,其中有5個品項更是超過24個月。不論是陳昭姿或癌症希望基金會提供的數據,兩者都與健保署對外公告的審查時間有明顯落差。
根據台灣病友聯盟在2023年10月底針對聯盟團體調查資料顯示,16個病友團體中有9個病友團體認為,健保新藥等待的時間太長,且16個病友團體更全都表示「健保審查的流程不透明、難以掌握進度」。
台灣病友聯盟理事長吳鴻來表示,「對病友來說,根本無法掌握自己關心的藥品審查走到哪個階段,也不知道要等待多久,這樣沒有規則可循、無法預期與追蹤的漫漫等待,對病人而言是非常煎熬的過程。」
雖健保署日前表示已爭取於113年健保總額擴大編列新藥新科技(含新藥、新特材、新增診療項目-NGS)及暫時性支付預算,達70.93億元,相較於112年新醫療科技預算增加38.19億元,成長率為116%。
不過究竟新藥審查還有哪些困境?健保署又該如何改善?
(延伸閱讀:「平行審查」明年元月上路 新藥1年可納健保 專家:應先解決點值、缺藥問題 )
百元電商出貨可追蹤,上億新藥案件更應全民監督進度
癌症希望基金會與台灣病友聯盟、罕見疾病基金會呼籲,新藥審查時程應「公開透明、可被追蹤監督」,才能讓各界了解目前新藥審查的進度。
癌症希望基金會倡議發展部主任蔡士敏表示,以民眾電商寄貨或訂餐為例,從出貨到收件有一定的時程規範,且可從訂購開始追蹤送貨進度,直到完成寄件,「假如一個幾百元的商品都可以追蹤,一個動輒數千萬、甚至上億元的新藥案件更應要讓全民監督進度。」因此,3個病團共同提出健保審議時程應「透明化、可被追蹤」2大訴求。
2020年確診肺癌第4期的陳媽媽,因治療肺癌的標靶藥還沒有納入健保,不得已只能年燒百萬自費,讓家庭苦苦支撐。當陳小姐2022年發現這支藥品被放到新藥意見平台上,代表可能已進入健保審議程序,讓一家人感到終於要看見一絲曙光,然而迄今近2年,仍不見這支早已在健保審議中的藥品。
蔡士敏表示,心急如焚的陳小姐來曾來電詢問癌症希望基金會,如何得知藥品審查進度?「遺憾的是,恐怕連健保署都沒有辦法確切回答這個問題。」陳小姐苦笑說,攸關救命的藥品一入健保審查,彷彿進入漆黑山洞,病人不知道得等多久。
癌症希望基金會執行長蘇連瓔表示,「不論藥品最後是否納入健保,至少應該有可被追蹤的審議進度,讓病人有心理準備,較能掌握藥品可能納保時程,而不是像現在這樣苦等不知盡頭。」
3大病團提出「2大訴求」,讓病友不再無止盡等待
陳昭姿表示,從一代健保時期就開始統計新藥納入健保時間,所採用的計算方式是以「廠商送件到健保署的公文日期」起算,她強調,「不管中間經過什麼行政流程或廠商補件,始終還是病人們的等待期,『病人何時等到藥』才是重點。」
蘇連瓔指出,病友團體只能從「新藥及新醫材病友意見分享平台上架日」算第一天,健保署統計的第一天起算日為何無法知悉,「大家的『第一天』起算點不同,自然出現統計數字不一、落差極大的狀況。」他表示,追究根本原因就是因為目前健保審查時程沒有公開透明、難以追蹤,導致各界統計起訖點缺乏一致性。
罕見疾病基金會執行長陳冠如也指出,在11月初甫發布的罕病創新治療及藥物給付建言書中即已訴求「基於政府當責及公開透明,罕病新藥自申請到給付生效應公布各階段明確時程。」
蘇連瓔呼籲,除了應當有公開透明的機制和規則,也應該開放給公眾追蹤審查進度,讓病人看得到等待的盡頭,讓各界對健保審查制度更有信心。陳冠如也表示,「政府決策應該要公開透明,病人及民眾才能理解決策的依據與原由,這是民主治理最基本的要求。」
有鑑於此,3大病團提出以下2大訴求:
1. 時程公開透明
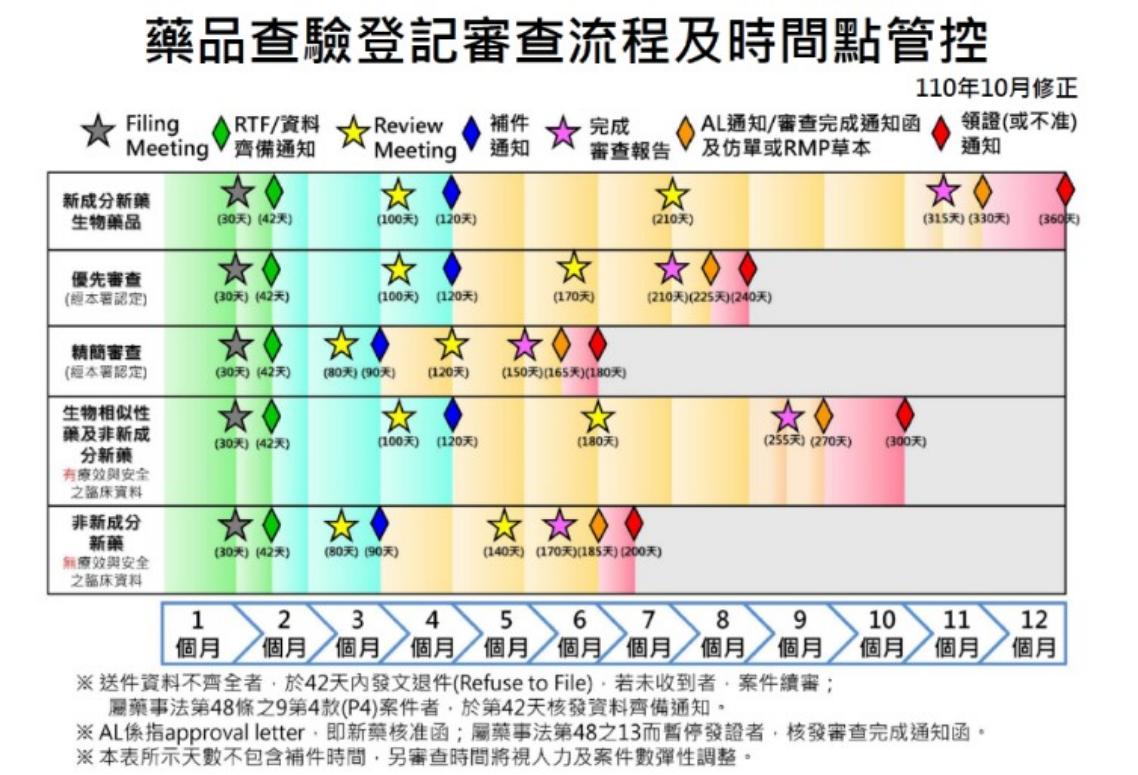
台灣並非沒有好的經驗可循,以食藥署(TFDA)為例,其設有規範清楚的藥品查驗登記審查時程,清楚標示藥廠送件後多久會討論、通知補件、完成審查、核發藥證等,讓各界有規則可循。
2. 進度可被追蹤
食藥署藥品查驗登記除了有公開時程表,也設有線上平台可供廠商追蹤審查進度,明確流程方便追蹤了解進度。健保署過去也曾設立過線上平台以供藥廠追蹤審藥進度,可惜未能持續運作。
為何台灣新藥審查比他國更久?如何解決?
健保署為加速新藥審查,預計於2024年設置「平行審查」制度,加速納入健保時間、預計可節省6個月,癌症希望基金會、台灣病友聯盟、罕見疾病基金會肯定健保署的努力,但也希望改革措施能經得起公眾檢驗,更需要審查制度的透明化與可追蹤性,才能了解審查進度及卡關原因,以利對症下藥,也才能檢視新政策是否有效。
台灣藥品行銷管理協會發言人、開業藥師沈采穎接受《信傳媒》電訪時曾表示,過去審查新藥需要耗費比其他國家更長的時間,可能跟健保署的行政人力不足有關。「美國行政人力支出佔整個健保支出高達25%、日本也有20%,我們大概是在10%以下,是不是人力不足造成審查速度比較慢?」
不過她強調,「最重要的一點是,審查會比較嚴格、規範也很多,最後審核下來可能只有3成的病人可以用,因為經費有限。」
蘇連瓔也強調,若是因新藥預算不足造成卡關,則應讓社會大眾知道,來年編列預算更應編列充足,才能解決審查緩慢的現象。