疫苗大廠國光生技27日宣布武漢肺炎(新冠)疫苗一期人體試驗本周開打,若一期臨床試驗順利,預計11月進入二期臨床試驗,目標收案3000人,已有包括捷克、巴西等國家表達合作意願,值得一提的是,國光生技董事長詹啟賢表示,目前已經開始量產疫苗,12月底前可達數10萬劑存量,預計明年農曆年前生產150萬劑,到年底如果衛福部通過便可上市,「等到通過再生產可能就來不及了。」、「如果沒有通過我這批可以整批倒掉。」
國光生技於5月宣布通過動物試驗,8月19日首度獲得衛福部通過核准進行武漢肺炎疫苗人體試驗,國光生技與台大感染科合作的新冠疫苗一期人體臨床試驗正於台大醫院收案中,臨床試驗計畫主持人為台大張上淳教授,臨床試驗收案對象為20至60歲的健康成年人,收案人數約70人,若一期臨床試驗順利,預計11月進入二期臨床試驗,希望在明年農曆年前收案滿3000人,不排除採國際合作。
自5月到8月,國光生技按照衛福部要求補件,在27日也公布各像檢測報告,例如對剛出生24小時內的實驗老鼠在施打疫苗後是否造成脾臟、肺臟、心臟、肝臟、腦部、腎臟等損害,或者注入高劑量疫苗觀察後續反應,還有針對不同變異的武漢肺炎病毒株之效力是否顯著。
人體一期本周開始施打,預計11月人體二期
針對有媒體問起,武漢肺炎病毒變異迅速,國光的疫苗會不會效益有限,國光生技表示,國光疫苗是針對病毒棘狀蛋白質構造上的受體結合區域(Receptor-binding domain; RBD),簡單的說病毒要開門進入人體細胞,那個鎖就是RBD,雖然目前病毒已變異成六大族群,但RBD的部分相當穩定。
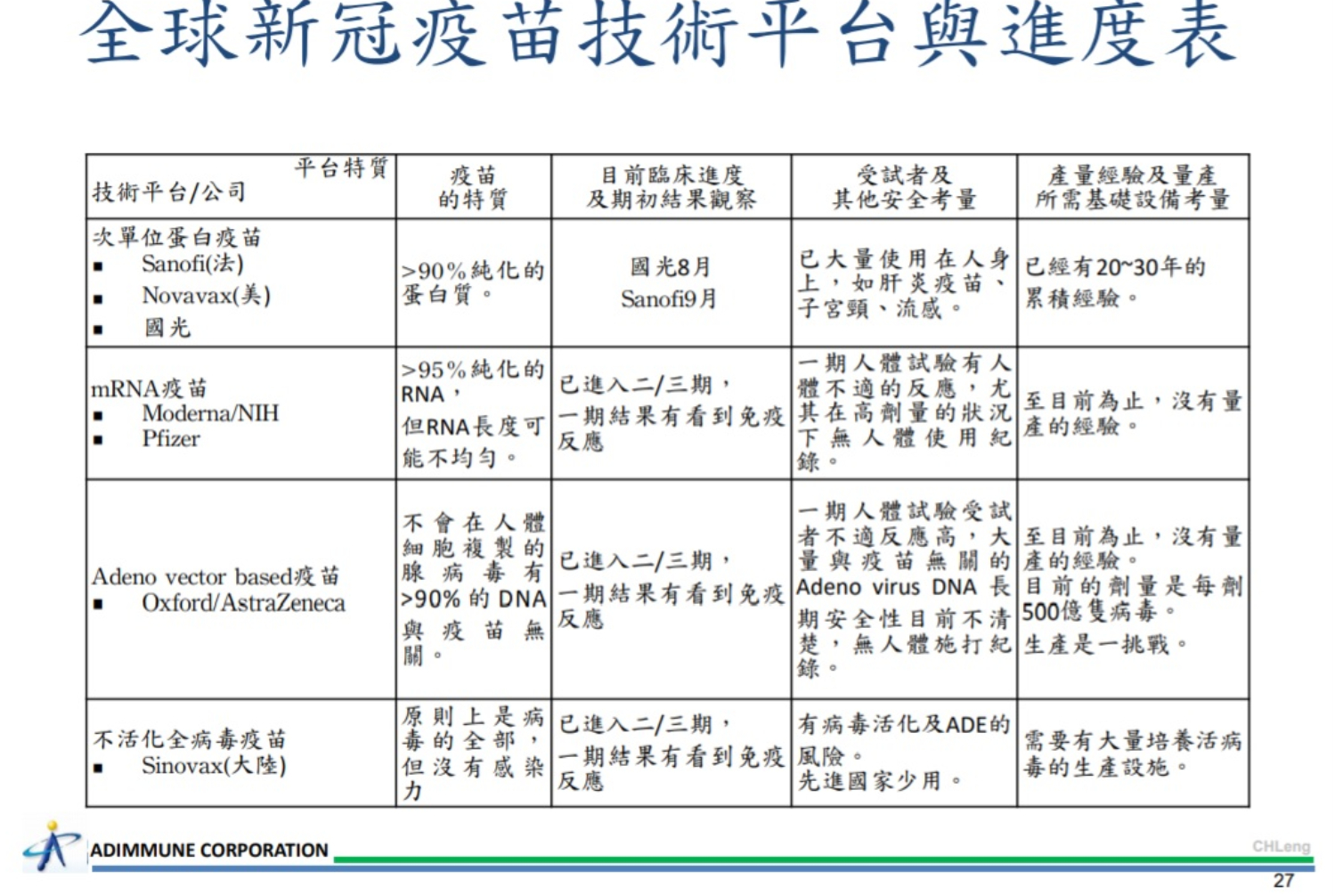
目前全球有169支候選疫苗,進入人體試驗的不多,國光生技採用次單位蛋白疫苗,與法國國際大廠賽諾菲SANOFI、美國Novavax廠一樣,而法國賽諾菲的人體試驗9月才開始,並且曾發下豪語「將成為國際上最快拿到藥證的疫苗。」在亞洲日本委託大學實驗室進行開發、韓國則是與國際合作協助生產、印度則與英國大廠合作生產,並無自行研發,因此國光生技目前是亞洲各國中除了中國、俄羅斯,疫苗進度最快者。
中國使用的技術是病毒減弱打進人體產生抗體,但缺點是如果復發會非常嚴重,俄羅斯未公布使用技術平台,但人體試驗只進行不到100人。
「我們已經開始量產了。」詹啟賢表示,國光已在台中潭子開始量產疫苗,預計到12月底前累計數十萬劑,目標明年農曆年過年前達100到150萬劑,將以醫護人員為優先施打對象。
年底前量產數十萬劑,若通過以醫療人員優先
詹啟賢說,前期投入各種實驗支出超過5億元,單單一個必須在P3實驗室做的倉鼠試驗就耗資2800萬元,政府宣布的資助還沒定案,「人體試驗已經進行,我們也已經在量產,還沒拿到任何補助就先量產了。」他也說,這批疫苗當然得通過衛福部的核准才可以打,到時候萬一沒有過關怎麼辦?「我可以全部倒掉。」
此外,詹啟賢也提到和國內其他生技公司策略聯盟,擴充產能,目前和中裕、蛋白藥專長的永昕已確定要合作,台康生技還在猶豫,他將組疫苗國家隊。在充填部分,疫苗要求特殊玻璃不能沾黏、不能變異,全部仰賴國際進口,目前的填充年產能是2500萬劑,明年將擴產一條填充產能1億劑的生產線。
他補充說,目前包括新加坡、越南、捷克、土耳其、巴西都表達實驗合作意願,至於人體實驗合作收案條件是否與未來疫苗供應綁在一起,詹啟賢強調台灣優先,而且在這場疫情中,疫苗是一個國家的戰略物資,台灣總不能需要的時候去跟國外買、去討,萬一討不到怎麼辦,因此不是只從國光的發展,要從台灣的觀點來看這整個疫苗發展。